
QbSyst2e.18.html
Système du Québécium
Suivant QbSyst2e.19.html
Précédent
QbSyst2e.17.htmlDébut QbSyst2e.1.html
Chapitre 10
Notions sur la classification de Mendeleev

Fig. 217. Dimitri Ivanovitch Mendeleev (1834-1907).
Le tableau périodique des éléments de Mendeleev.
Au contraire de certains autres domaines de la connaissance telle la génétique, la classification des éléments d'aujord'hui ne peut se comprendre sans un rappel historique. On peut comprendre et perfectionner la génétique sans revenir sur les travaux de Linné ou de Mendel. Mais on manquerait des indications essentielles si on ignorait les travaux de Mendeleev bien sûr, ceux de ses prédécesseurs d'au moins un ou deux siècles avant lui, ceux de ses contemporains et de plusieurs qui l'ont suivi de peu.
Dans la chronologie prémendeleevienne, faisons simplement rappel du phlogistique de Stahl, des triades de Döbereiner, des diagrammes de Lothar Meyer, des octaves de Newlands, de l'atomisme de Canizzarro, de l'antiatomisme de Dumas suivi de Berthelot. Nous nous nous attardons à Lavoisier et Chancourtois.

Fig. 218. La liste de Lavoisier. 1787, 1789.
On trouve un excellent exposé sur cette classification et sur l'historique des éléments dans le livre de de Povere (La classification périodique des éléments, la merveille fondamentale de l'univers, DeBoeck Université 1999, 2002) et des exposés innombrables sur internet, un point de départ commode étant :
http://mendeleiev.cyberscol.qc.ca/carrefour/personnages/inertes/
Le livre de de Povere est une consécration du tableau de Mendeleev dans sa forme officialisée par les recommandations de l'IUPAC, soit ce que nous appelons plus loin le format court en 18 colonnes. (Figure 237).
Lavoisier 1789.
Ne remontons ni au déluge ni aux Anciens grecs. Commençons avec Antoine-Laurent Lavoisier (1843-1894), souvent appelé Louis Lavoisier. Il publia un "Tableau des substances simples", présenté à l'Académie des sciences en 1787, imprimé dans son Traité élémentaire de chimie en 1789, réimprimé sous l'Empire français en 1849. Figure 218.
On peut voir là le premier essai de mettre de l'ordre dans les éléments, appelés alors substances simples, en les distingant des corps composés et en faisant disparaître le concept de phlogistique.
http://histoirechimie.free.fr/Lien/LAVOISIER.htm
Notons que le concept de phlogistique était alors d'origine encore récente. Il fut créé par Stahl(1660-1734).
Son tableau pourrait le faire passer pour un anticipateur d'Einstein et de E = mc2, puisqu'il inclut lumière et calorique parmi les substances simples. De nos jours, les photons lumineux et autres sont classés comme des particules mais pas avec les éléments.
On peut y voir une autre anticipation puisque, selon lui, l'hydrogène est "un élément des corps"ce qui s'accorde avec les vues modernes. Prout devait le suggérer explicitement quelques années plus tard.
En revanche, son idée de distinguer 5 substannces simples qui sont éléments des corps est ambivalente. On peut y voir un rappel de la théorie antique des 4 éléments.
Sa liste contient 23 éléments que l'on connaissait à l'état élémentaire. 10 autres figurent étant connus à l'état d'oxydes ou de radicaux. Total 33 éléments.
De son oeuvre deux concepts sont absents : celui d'atome et celui, corrélatif, de valence.
Ses travaux furent appréciés de plusieurs de ses contemporains, mais ne l'empêchèrent pas d'être guillotiné.

Fig. 219. Alexandre Béguyer de Chancourtois (1820-1886).
Chancourtois 1862.
Nous sautons au siècle suivant.
http://gric.univ-lyon2.fr/gric3/recherche/CR/CR-16-99.pdf
Alexandre Béguyer de Chancourtois établit la 1re classification rationnelle montrant une périodicité. Sa vis tellurique originale est datée du 7 avril 1862.
Pour comprendre ses textes, nous lirons poids atomique quand il écrit nombre caractéristique ou caractère numérique, et valence quand il parle de capacité chimique. En ordonnées y le poids atomique. En abscisses une fonction linéaire de y, avec un paramètre égal à 16, qui représente le pas de sa représentation hélicoïdale.
x = y
............x = y - 16............ x = y - 32............ x = y -48x = y - 64
............x = y - 80............x = y - 96............x = y - 112............
C'est en somme une représentation à une dimension avec retour à 0 après 16 unités. Le diagramme plan mesurait 16 unités selon x et il était enroulé sur un cylindre. Il arrêtait au tellure = 128.
Dans ce diagramme, la ligne oblique revient à l'origine périodiquement. Dans le langage des symétries, il y a une symétrie répétitive.
Le paramètre choisi pour cette périodicité, égal à 16, donnait des résultats indéniables dans l'ensemble des 8 périodes. Les alignements FCl, LiNaKRb, (Gl)MgCaSr, (NP), BoAl, CSi, OSSeTe sont ceux admis aujourd'hui, concernent 21 éléments sur un total de 48 qu'il mentionnait.
Deville et la recherche de symétrie.
Charles Sainte-Claire Deville opposa à Chancourtois une réclamation de priorité. C'est le seul commentaire que nous avons pu trouver de la part d'un contemporain, et ce commentaire vient confirmer la découverte de Chancourtois. Deville accepte évidemment l'existence des symétries marquées par une ligne oblique. Il signalait un tableau intitulé "Éléments des substances naturelles" qu'il avait publié en 1855. Le tableau de Deville renferme des colonnes et une disposition oblique mais il est difficile d'y apercevoir un quelconque signe de périodicité.
Deville confirmait l'existence des symétries notées par Chancourtois, puisqu'il prétendait les avoir anticipées.
Chancourtois et l'atome.
Chancourtois employait avec prudence la notion d'atome, ce qui se comprend d'une part parce que la notion d'atome était mal établie et controversée et d'autre part parce qu'il était parrainé par Jean-Baptiste Dumas, qui était l'un des 4 commissaires chargés d'approuver ses publications. Les autres commissaires étaient Daubrée, Delafosse et de Senarmont. Or Dumas combattait cette notion et ne s'exprimait qu'en termes d'équivalents. Il est assez étonnant, dans ces conditions, que les valeurs caractéristiques adoptés par Chancourtois aient conduit aux périodicités connues. Certaines de ses valeurs s'appuyaient sur les chaleurs spécifiques.
Il insistait sur des aspects géométriques, mathématiques, musicaux, géologiques et philosophiques, ce qui était déconcertant et ce qui rend ses textes difficiles à comprendre, encore aujourd'hui. mais ce qui en fait un précurseur à certains égards. Il suggérait un lien entre la classification des éléments, les raies spectrales, la portée musicale et il emploie le mot période.
Il rattachait ses diagrammes aux nombres premiers et surtout aux nombres entiers (en accord avec l'hypothèse de Prout), à la théorie des nombres, aux multiples de 2 et de 4, et aux idées de Pythagore. Il traitait certains radicaux tels que ammonium et éthyle à la manière de corps simples. Certaines de ses considérations sur le fer suggèrent que dans sa pensée, un élément pouvait avoir plus d'un caractère numérique. Il fut un pionnier et un visionnaire.
En Angleterre, Wollaston combattait la théorie atomique. La doctrine des équivalents, soutenue par Marcellin Berthelot, n'est disparue en France qu'en 1925.
http://histoirechimie.free.fr/
http://perso.wanadoo.fr/ours.courageux/roman.htm
On ne l'empêcha évidemment pas de publier ses idées, puisque plusieurs communications de lui apparaissent aux Comptes rendus de l'Académie des sciences en 1862 et 1863. Il était bien vu des autorités, puisqu'il était un familier du prince Napoléon. Annexe B.

Fig. 220. Vis tellurique de Chancourtois annotée. "On a entouré d'un cercle les pois correspondant aux caractères numÉriques dits secondaires". H1, H2,
Li7, Gl9, B11, C12, Az14, O16, F19, Na23, Mg24,25, Al27, Si28, P31, S32, Cl35, K39, Ca40 etc.Pourquoi donc ses contemporains en France sont-ils restés indifférents à son oeuvre? Et surtout, pourquoi sa mémoire est-elle si peu honorée en France?
Son oeuvre allait être éclipsée 7 ans plus tard par celle de Mendeleev, plus exclusivement attaché aux aspects proprement chimiques et introduisant pour la 1re fois la valence sous la forme du degré d'oxydation.
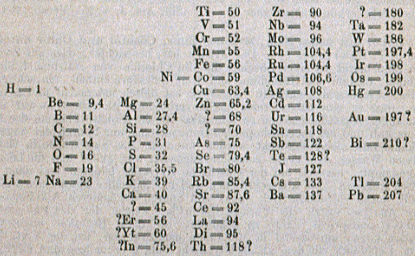
Fig. 221. Le tableau original de Mendeleev. La 1re publication en 1869. 19 lignes, 6 colonnes. Z. Physik, 1869, 404-5.
Mendeleev 1869.
Sept ans après Chancourtois, Mendeleev (1834-1907) fit un travail exhaustif celui-là, sur les 63 éléments connus alors. Ses résultats furent bien reçus et ce fut l'enthousiasme unanime lorsque ses prédictions furent confirmées.
On peut faire remonter à cette circonstance la tradition de n'accorder de valeur à une découverte que si elle possède une valeur prédictive confirmée par la suite des évenements.
L'histoire de la radioactivité et de laphysique subatomique est là pour confirmer ce principe.
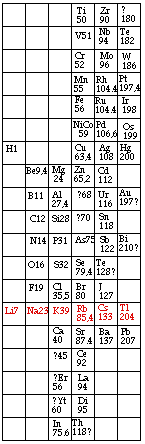
Fig. 222. Le tableau original de Mendeleev en 1869 mis en cases. Ni et Co dans la même case; 19 lignes, 6 colonnes; une ligne mise en évidence : les alcalins. Poids atomiques.
Il est inexistant en classification biologique si l'on tient compte de la réputation que Linné et Cuvier se sont acquise simplement en mettant de l'ordre dans les collections de spécimens. Ils n'ont fait aucune prédiction.
Il était animé par la conviction que l'ordre nécessaire des éléments ne dépendait pas précisément de leur masse, mais d'un autre paramètre lié à leur masse. Pour cette raison, il intervertit les positions de plusieurs éléments dans sa liste. La découverte des charges positives Z du noyau devait confirmer ses vues. L'ordre approprié est celui des valeurs de cette charge ou numéro atomique Z, non de la masse atomique .
Son 1er tableau, paru en 1869, a 19 lignes et 6 colonnes. Les poids atomiques croissent de haut en bas dans les colonnes et les éléments de propriétés semblables occupent une ligne. Son 2e tableau, en 1871, adopte la disposition à angle droit avec la précédente, généralement adoptée depuis ce temps. On y trouve 12 lignes remplaçant 6 colonnes et 8 colonnes remplaçant 19 lignes. chaque colonne est appelée un groupe. Sept groupes sont subdivisés en 2 et un en 4 de sorte que l'on peut parler de 18 subdivisions et même de 18 colonnes.
Son tableau montre le degré d'oxydation, ce que nous appelons valence électropositive.
Les tableaux originaux ne contiennent pas de cases. Nous les présentons refaits avec des cases. Figures 222, 223.
La mémoire de Chancourtois était associée en France à la découverte de Mendeleev si l'on en juge par la figure 225, tirée du Nouveau Larousse Illustré paru vers la fin du 19e siècle.
Les temps modernes, de Bohr à Seaborg.
Le tableau périodique de 1871 devait bientôt s'enrichir des 7 gaz rares et de nouveaux éléments, surtout des terres rares, la dernière découverte étant le lutécium de Georges Urbain, et d'éléments radioactifs. Le numéro d'ordre est devenue impérativement rationnel avec la découverte des charges du noyau par Moseley établisant la valeur de Z.
L'atome d'hydrogène de Bohr - Rutherford, Schrödinger et le principe de Pauli ajoutèrent à la compréhension du tableau. Les découvertes de transuraniens par Seaborg permirent de comprendre comment il se termine.
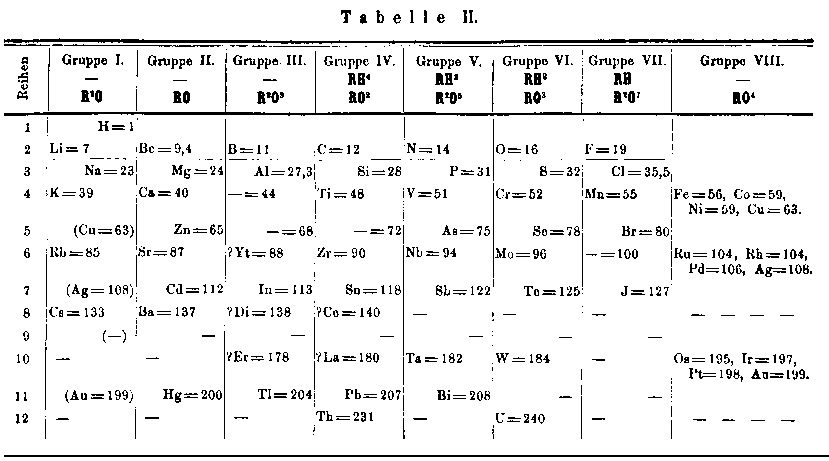
Fig. 223. Le tableau de Mendeleev en 1871. Le tableau de Mendeleev en 1871. Annalen der Chemie.
12 lignes, 8 colonnes subdivisées.
http://www.chemistrycoach.com/periodic_tables.htm#Periodic Tables of Historical Interest Le texte Londres 1871.

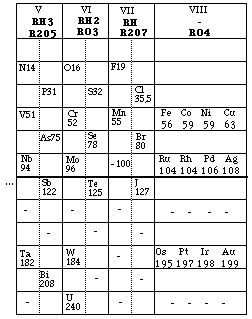
Fig. 224. Le tableau de Mendeleev 1871 mis en cases. 12 lignes, 8 groupes. Au total 18 colonnes après subdivisions.
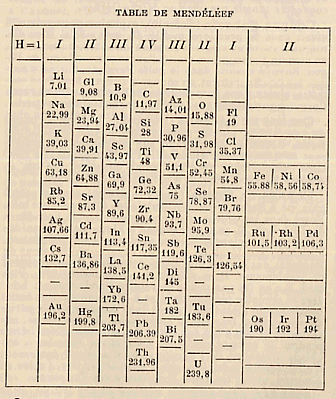
Fig. 225. Le tableau de Chancourtois-Mendeleev, dans le Nouveau Larousse illustré 1900ca. La disposition oblique permet l'enroulemenrt sur un cylindre avec une continuïté de lecture. Poids atomiques. Rédaction probablement d'avant 1900 puisque les gaz rares sont absents.
Fig. 226. Arbre périodique des éléments de Fernando Dufour. 1981. Aperçu. Les périodes sont de longueurs égales 2 par 2 à partir de la 2e. http://mendeleiev.cyberscol.qc.ca/carrefour/objets/tableauxarbredates-dufour.jpg
Les versions.
L'aspect des toutes premières classifications, celle de Chancourtois en 1862, celle de Newlands en 1865 et même celle de Mendeleev en 1869, permettait d'espérer que 8 colonnes suffiraient. Cependant, Mendeleev en 1871 subdivisait déjà ces 8 colonnes et les tableaux modernes comptent jusqu'à 50 colonnes. Le nombre de lignes, en revanche, n'a guère augmenté, parce qu'on cherche à en attribuer une par période et on ne compte que 7 périodes réalisées. Ceci pour les tableaux rectangulaires par ligne et colonnes.
Plusieurs dispositions pittoresques ou d'intention pédagogique existent, comme celle de Giguère et celle du contemporain Dufour, qui sont tridimensionnelles. Figure 226.

Fig. 227. Tableau périodique de Mendeleev monumental 32 colonnes en hémicycle, avec spécimens. Format long. 2001. (Yvon Fortin, Santa Maria Feira).
On trouve sur internet des dizaines de "tableaux périodiques des éléments de Mendeleev", peu différentes entre elles dans leur organisation. Les perfectionnements récents portent surtout sur les propriétés inscrites dans les cases ou accessibles par liens et boutons, y compris masses atomiques, isotopes, rayons atomiques, températures de fusion et d'ébullition, périodes de désintégration des noyaux etc. Ces tableaux sont devenus des tables de constantes.
Une version en 9 lignes et 18 colonnes paraît être la plus répandue. On l'appelle version courte. Une version longue a 7 lignes et 32 colonnes.
Une version monumentale en hémicycle avec spécimens de chaque élément a été installée au Portugal par le Québécois Yvon Fortin. C'est un tableau long. Figure 227.
Un exemple de tableau court montre une numérotation multiple des colonnes, inspirée de celui de Mendeleev 1871. Martin Parenteau, Université de Sherbrooke. Figure 228.
Un autre exemple est le tableau de Seaborg en 1989, étendu jusqu'au numéro Z = 168. C'est un tableau court en 18 colonnes pour la partie principale. Figures 229, 230.
Jean Perrin apporta une contribution importante démontrant l'existence des atomes, décrite dans son livre devenu célèbre "Les Atomes" paru en 1913. De son côté, son fils Francis Perrin apporta sa contribution en 1973, en proposant un tableau périodique d'un tenant original en 34 colonnes et 7 lignes qui est resté dans l'ombre et qui n'est même pas mentionné par Mazurs en 1974. Figure 231.
Charles Janet, en 1927, proposa une classification d'un tenant en 8 lignes et 32 colonnes basée sur les formules électroniques. Ce tableau faisait place aux éléments transuraniens découverts à partir de 1940. Il avait 42 ans d'avance sur celui de Seaborg en 1969. Figures 232, 233.
Il est incroyable que cette classification anticipatrice et logique par excellence de Janet n'ait pas été adoptée universellement depuis sa création il y a 75 ans déjà. À peine de rares auteurs en font mention avec une indulgence charitable. Deux explications se présentent : incompréhension collective; persécution. Il faudrait pour s'y comprendre la sagacité d'un autre Bachelard. Réf. Mazurs 1957, 1974. Chem. News, 138, 372-374; 388-393(1929) Charles Janet, The helicoidal classification of the elements.
La Structure du Noyau de l'Atome Considérée dans la Classification Périodique des Elements Chimiques.
67 pages 1re édition Beauvais: Imprimerie Départmentale de l'Oise, 1927.
Voyez aussi Tarantola.
http://www.ccr.jussieu.fr/tarantola/
http://web.ccr.jussieu.fr/tarantola/Files/Professional/Mendeleev/Janet_1929.pdf
Tous ces tableaux bidimensionnels sont organisés en lignes et en colonnes : nous dirons d'eux qu'ils sont des tableaux de Mendeleev, versions du tableau original de 1871.
On note que la subdivision des familles et celle des colonnes en A et B est absente des tableaux de Seaborg et de Perrin.

Fig. 228. Tableau périodique de Mendeleev. Martin Parenteau, Univ. de Sherbrooke. 16 familles de IA à VIII et les 2 familles Lanthanides et Actinides, 18 familles au total. Format court 18 colonnes. Inséré avec l'accord de son auteur.
http://www.physique.usherb.ca/~mparento/TableauPeriodique/ TableauPeriodique.Tableau.html "
http://www.physique.usherb.ca/~mparento/home.htm
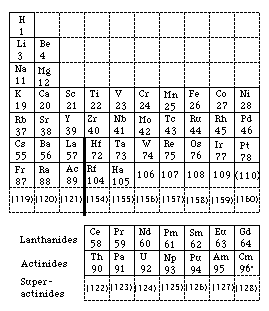

Fig. 229. Tableau de Seaborg en 1969 et 1989. Réécrit. ["Tableau périodique moderne des éléments(les numéros atomiques des éléments non découverts sont entre parenthèses)]". Chem. news 1989 et F. Perrin 1974.
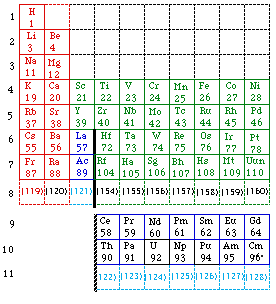
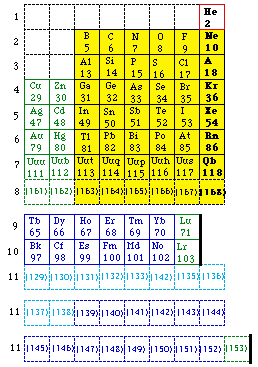
Fig. 230. Le tableau de Seaborg schématisé. 168 éléments dont certains non découverts. Schéma marquant les blocs spdfg. Format court sauf la ligne 11. 1969.

Fig. 231. Le tableau de Francis Perrin. 137 éléments en 7 lignes et 34 colonnes d'un tenant. Sc. et Avenir, 1974, 192, 24-26. C. r. 277 C, 809-812, 1973.Voyez QbPerrin1.gif QbPerrin2.gif QbPerrin3.gif QbPerrin4.gif
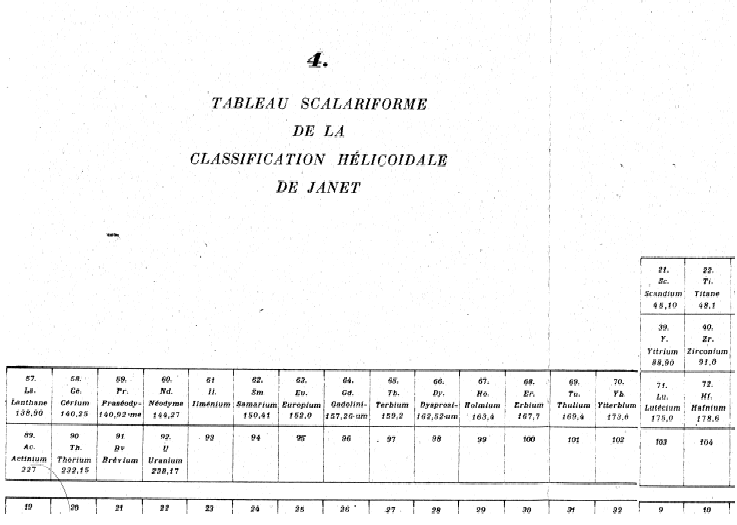
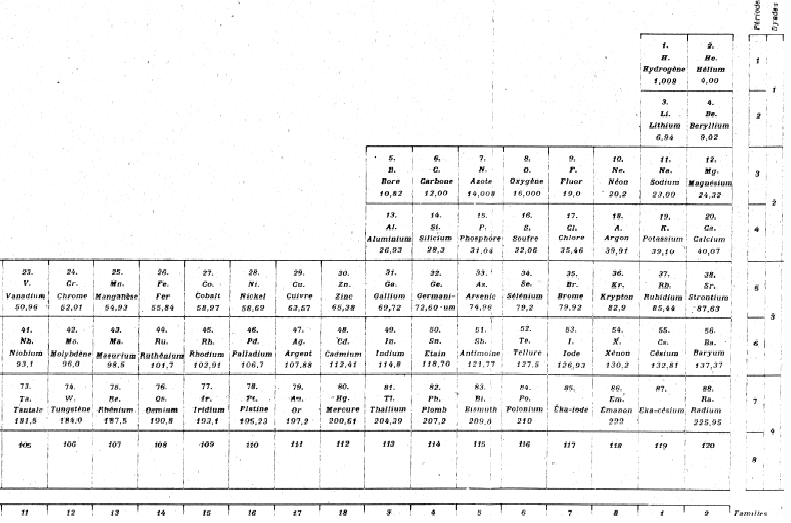
Fig. 232. Tableau de Janet 1929. 120 éléments en 32 colonnes et 7 lignes.
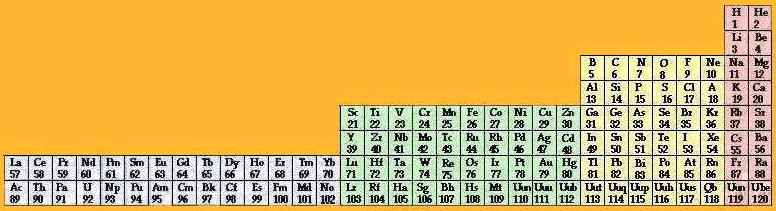
Fig. 233. Tableau de Janet refait.
Les paramètres de la classification.
Voici quelques paramètres reconnus dans la classification logique des éléments.
Les caractères organoleptiques ont servi à Lavoisier, qui met dans une classe à part les gaz et autres "corps simples" subtils comme la lumière et la chaleur.
Déjà Lavoisier recourait aux propriétés chimiques reliées à l'oxydation et à l'acidification pour établir 3 classes :
............
Substances simples, non métalliques, oxydables et acidifiables;............
Substances simples, oxydables et acidifiables;............
Substances simples, salifiables, terreuses.Une propriété chimique essentielle d'un élément, reliée à oxydation et acidification, est la valencce électrochimique ou électrovalence soit l'aptitude à former un cation par ionisation avec perte d'électrons ou un anion par ionisation avec gain d'électrons; un cation ou radical basique s'unit à un anion radical acide pour donner un sel.
Une autre propriété essentielle de certains atomes est la valence covalente ou covalence soit l'aptitude à s'unir à un autre atome par mise en commun d'électrons.
Ces valences déterminent, dans le tableau de Mendeleev de 1871, les groupes ou familles d'éléments de I à VIII. Les valences normales restent comprises entre 0 et 8.
D'autres propriétés peuvent servir, comme l'aptitude à la formation de complexes, aptitude qui dépend de valences covalentes, la réactivité avec l'eau etc. Ainsi les éléments du groupe I réagissent violemment sur l'eau et sont les métaux alcalins.
La masse atomique a détrôné l'équivalent définitivement, à partir de 1895. De plus, depuis Moseley, les numéros d'ordre tirentt leur justification physique d'un paramètre plus important que la masse, laquelle varie selon l'isotope considéré : ils représentent le numéro atomique Z. Il y a pluralité d'éléments, mais pluralité avec limitations. Z est la variable portée en abscisses.
Les valeurs de Z sont entières et se succèdent sans lacunes en abscisses avec retours à la ligne. Tous les tableaux modernes respectent le principe de cette mise en ordre selon les valeurs de Z.
On peut dire que le modèle universel des tableaux des ééments de Mendeleev est un alignement de cases ayant chacune un numéro allant de 1 à 109, 118 etc.
![]()
Fig. 234. Le modèle universel des tableaux des éléments de Mendeleev : des numéros atomiques ordonnés alignés.
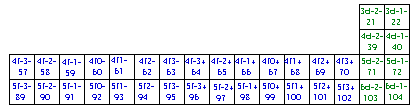
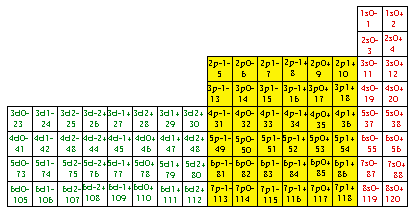
Fig. 235. La formule du québécium 118 dans la grille de Janet. Les blocs spdf des électrons de cette formule.
Grille de Mendeleev du québécium.
Les blocs s, p, d, f.
Les 118 électrons de la formule du québécium, apparaissant à la figure 212, peuvent trouver place dans une grille de Mendeleev du type de celle de Janet. Figure 234.
Cette figure manifeste les blocs d'électrons spdf, avec les couleurs RJVB. Il y a correspondance entre ces blocs et les blocs d'éléments. Il y a correspondance uni-univoque entre les cases des électrons du québécium et celles des éléments de même numéro Z du tableau de Janet.
Un élément appartient nécessairement à l'un des 4 blocs : s, p, d ou f.
Aufbau et ausbau des éléments.
Dans le modèle atomique de Bohr, on procède à une synthèse ou genèse additive en partant de la case 1 de la figure 234 et en ajoutant graduellement une case après l'autre dans l'ordre jusqu'à la case 120. C'est la synthèse additive décrite au chapitre précédent et l'histoire a consacré, pour caractériser ce processus, le terme aufbau, construction, édification en allemand (l'école du bauhaus en architecture, construction de maisons en allemand, école de constructivisme, est célèbre).
La genèse additive est encore appelée remplissage parce qu'on imagine, dans un atome d'hydrogène et autour de lui, un espace disponible pour recevoir des électrons, des protons et des neutrons.
Dans la synthèse soustractive décrite, on procède en sens inverse, en supprimant des cases en partant de la case 120.
Afin de suggérer le parallélisme (l'anti-parallélisme) et la similitude d'intentions des 2 processus, nous proposons le terme de ausbau dépose, enlèvement en allemand, pour la genèse soustractive.
Les processus aufbau et ausbau sont indépendants de la théorie du système du québécium.
Critique du tableau de Mendeleev traditionnel.
Le tableau de Mendeleev faisant suite à la vis tellurique de Chancourtois a constitué un progrès remarquable dans la compréhension de la matière, la meilleure invention du millénaire a-t'on écrit (J.C. Roy). Amélioré par plus d'un siècle de découvertes et de réflexions, il a rendu d'immenses services à plusieurs générations d'étudiants et de chercheurs.
Il comporte des énigmes que l'atome de Bohr avec ses perfectionnements n'a pas résolues. Des énigmes aussi véritables que l'énigme de la vie.
Plusieurs le considèrent comme un instrument d'apprentissage tellement commode qu'ils ne voient pas d'intérêt à l'examiner critiquement. Certains semblent croire que l'exactitude du tableau de Mendeleev est démontrée par l'atome de Bohr. C'est là une fausse croyance. Faudrait-il parler à ce propos de non-science et demander l'aide des sceptiques pour la déraciner? Référence Scerri.
http://www.chem.ucla.edu/dept/Faculty/scerri/pdf/Erkenntnis.pdf
http://www.amsci.org/amsci/articles/97articles/scerri.html
http://www.chem.ucla.edu/dept/Faculty/scerri/pdf/Atkins_critique.pdf
Des règles idéales...
La pluralité des éléments est découpée en périodes. Une période se termine avec un gaz rare.
L'organisation du tableau périodique est comme suit. Il est constitué de cases renfermant chacune un élément, à l'intersection de colonnes et de lignes.
............
Une colonne renferme un groupe ou une famille d'éléments de mêmes propriétés, notamment de même valence. L'électrovalence positive et la covalence sont égales à Z-Zo et l'électrovalence négative est 8-(Z-Zo). Zo est le numéro atomique du gaz rare inférieur.électrovalence positive = Z-Zo
covalence = Z-Zo
électrovalence négative = 8-(Z-Zo)
............
Une ligne ou une rangée comprend une période et est composée des éléments de familles diverses se succédant.............
Une case résulte de l'intersection d'une ligne et d'une colonne, elle renferme un élément.... mais des dérogations et des problèmes.
Des périodes?
Un phénomène périodique revient à intervalles fixes. Exemples les oscillations du courant 60 Hz ou 50 Hz et les 12 notes musicales de la gamme diatonique.
Or dans les périodes du tableau de Mendeleev les soi-disantes périodes ont pour longueur 2, 8, 18 et 32 cases. Il y a effectivement des domaines de périodicité proprement dite, car on observe 2 périodes de 8 cases, 2 périodes e 18 cases et 2 périodes de 32 cases.
Il faudrait le dire et ne pas enseigner qu'il y a une périodicité véritable dans l'ensemble du tableau.
Mieux vaudrait parler de récurrences.
Des octaves très réelles se présentent, mais espacées par des séquences qu'on pourrait taxer de parasites et qu'on appelle de transition. À propos de musique. On peut objecter que la périodicité de la gamme, constante si on l'évalue en notes du clavier, est variable si on l'évalue en fréquences. Du moins existe-t'il l'évaluation en notes du clavier. De plus, l'évaluation en fréquences suit une loi en progression continue, alors que la progression est discontinue dans la suite des soi-disantes périodes d'éléments.
Un gaz rare, fin d'une période?
Ce critère est-il impératif et exigé par la nature des choses? Les composés ont une forte tendance à réaliser la structure électronique d'un gaz rare, soit l'oïde d'un gaz rare. Cette propriété exige-t'elle de définir le terme d'une période par la présence d'un gaz rare?
Un élément, une valence?
Cette supposée règle est loin de s'appliquer à tous les éléments.
Une colonne, une famille, une valence?
Les règles idéales ci-dessus ne sont applicables qu'aux périodes 2 et 3.
Elles ne s'appliquent pas à la période 1 qui est mise à part des autres.
Si on voulait les appliquer aux périodes suivant la 3e, il faudrait en conserver uniquement les 2 1ers et les 6 derniers éléments et changer les numéros atomiques en conséquence. Les éléments conservés ainsi sont dits réguliers, il y en a 48. Les éléments ignorés sont dits de transition et sont au nombre de 68. Il y a 2 périodes régulières, une période mise à part et 4 périodes de transition
L'intérêt des règles idéales est toutefois de faire reconnaître ces 3 catégorie de périodes.
Régularités. En réalité, les valences données par les dernières formules sont plutôt des limites supérieures en valeurs absolues.
Le modèle parfait des règles schématiques se rencontre exclusivement dans les périodes 2 et 3, où les 8 colonnes ont chacune 2 éléments, soit 16 au total.
Il est inapplicable à la période 1 qui n'a que 2 éléments.
Voici le décompte des éléments et des périodes à ce point de vue. Tableaux 60 et 61, figure 235.
Tableau 60. Régularités des périodes.
Période 1
...................Non, pour 2 élémentsLa période 1 est une période mise à part.
Périodes 2 et 3
...................Oui, pour 16 élémentsLes périodes 2 et 3 sont des périodes régulières
Périodes 4 et 5
...................Oui, en partie, soit pour 16 éléments sur 36.
...................Non pour les 20 autres élémentsPériodes 6 et 7
...................Oui, en partie, soit pour 16 éléments sur 64.
...................Non pour les 48 autresLes périodes 4, 5, 6 et 7 sont des périodes de transition.
Tableau 61. Régularité des éléments.
2 éléments mis à part de la période 1
48 éléments réguliers, périodes 2 et 3, parties des périodes 4, 5, 6, 7
68 éléments de transition, parties des périodes 4, 5, 6, 7
118 total
Une ligne, une période?
Colonnes divisées, lignes divisés, cases divisées. Pour accommoder tous les éléments d'une période de transition, on a divisé les lignes et les colonne et même les cases (dans les tableaux anciens).
Ainsi des colonnes sont divisées en A et B.
Ainsi une période occupe plus d'une ligne, un alinéa survenant dans la suite d'une période.
Une famille, une colonne?
Déjà dans sa publication de 1871, Mendeleev suggère que des familles peuvent occuper des portions de lignes.
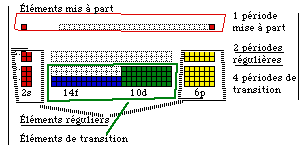
Fig. 236. Régularité, éléments et périodes. 32 colonnes, 118 éléments, dont 48 réguliers et 68 autres.
Les lanthanides, qui ont des propriétés notoirement voisines, sont placées sur une ligne. S'il fallait en former une colonne, le tableau deviendrait démesurément encombrant. Semblablement pour les actinides et, à un degré moindre, pour les 12 éléments de la mine de fer et ses homologues.
Les lanthanides et les actinides sont placés tantôt dans le corps du tableau et alors il est long, ayant 32 colonnes; tantôt en supplément au corps du tableau et celui-ci est dit court, ayant 18 colonnes. Figure 236, 237.
On rencontre des groupements, sinon des familles, occupant des lignes obliques et des plages : les éléments fluides de la figure 228.

Fig. 237. Les blocs spdfg du tableau périodique de Mendeleev : 7 périodes, 118 éléments; 8 périodes, 168 éléments. Format long 32 colonnes, format court 18 colonnes dans le corps du tableau. 118 cases occupées; 168 cases occupées.- L'adoption générale du format court, tel qu'utilisé par de Povere, économise l'espace mais tend à faire oublier l'existence trés réelle de 28 éléments relégués en annexe.
Le modèle de Bohr.
Il faudrait dire : les deux modèles de Bohr, le premier touchant l'atome d'hydrogène, le deuxième, les autres atomes.
Bohr1. L'atome d'hydrogène. L'atome d'hydrogène de Bohr, après divers perfectionnements de la mécanique quantique, représente cet atome avec une grande exactitude. C'est alors l'atome d'hydrogène de la mécanique quantique, définisant les 4 nombres quantiques nlms.
Bohr2. Les autres atomes. L'expérience a montré que ces nombres ont une valeur universelle, ayant permis de comprendre les spectres optiques des éléments entre autres. Bohr a pu expliquer l'organisation électronique des atomes qui est condensée dans la formule du québécium. (Annexe A). Il ne l'a pas démontrée.
Pour la démontrer, il faudrait résoudre le problème de plus de 2 corps en mécanique quantique. Ce problème général n'a pas de solution analytique. Diverses approximations permettent toutefois d'obtenir des résultats intéressants. Voici quelques références à ce sujet.
*Le champ self-consistent : on imagine un électron soumis au champ du reste de l'atome appelé coeur de l'atome, de charge nette +1 . Le problème est alors ramené à Bohr1.
*La règle de Hund : pour un triplet nlm, les valeurs consécutives du spin s sont d'abord toutes négatives puis toutes positives dans la séquence des Z croissants (aufbau).
NB. Dans la séquence des Z décroissants de la genèse soustractive (ausbau), les valeurs consécutives des spins sont d'abord toutes positives puis toutes négatives.
*La règle, purement mnémotechnique, nullement raisonnée donc, de Klechkowsky, et l'on commentera les exceptions de remplissage à cette "règle".
*La théorie prévoit que le comportement des électrons atomiques ne doit pouvoir se calculer que grâce à l'équation de Schrödinger. Malheureusement cette dernière ne peut être résolue dès qu'il y a plus d'un électron[16][17]. Hartree, Cowan, Slater, Latter, Fermi, Thomas. La première remarque à faire lorsque nous confrontons ce résultat expérimental à la mécanique quantique est que cette dernière a été pour l'instant incapable de prévoir la structure des PIA que nous constatons sur la figure 1. (Potentiels d'ionisation atomiques).
*R.P. Feynman lui même [17] écrivit "Avec 3, 4 ou 5 électrons, il n'y a aucun espoir d'obtenir des solutions exactes [pour le calcul des niveaux atomiques] et on ne peut pas aller jusqu'à prétendre que la mécanique quantique a fourni une explication précise de la table périodique".
Il est donc nécessaire de se demander si la mécanique quantique est effectivement la seule méthode qui puisse nous faire connaïtre les secrets de l'atome. Hervé Le Cornec.
http://www.net-trotter.com/hcl/aip/p9-x.html
R. P. Feynman, Mécanique Quantique, Version Française, InterEditions, Paris, 1979, § 19
http://www.umh.ac.be/~ichim/docs/studs02-03/atome-historique.html Dans cette référence, on trouve l'affirmation suivante. Attention, elle est fausse, se rapportant aux atomes autres que l'hydrogène. "B. Modèles atomiques....on peut alors déterminer les orbites permises, et calculer leurs rayons ainsi que leurs niveaux..."
http://www.unice.fr/cdiec/cours/infra_rouge/ir1/ir1_11.htm
Voyez Scerri plus haut.
Fontani et Costa ont communiqué à l'auteur des réflexions et critiques qui ont inspiré en partie la présente rédaction, sur les thèmes suivants : atome de Bohr, chimie, couches atomiques, géométrie, mathématiques, orbitales, périodicité, IUPAC. Avec leur aimable permision, ce texte est accessible comme suit: QbLesTempsFontani.html, Les temps ont changé.
Les propriétés des éléments.
Le modèle de Bohr2 offre un modèle expliquant dans beaucoup de détails comment se classifient les éléments, cependant, il n'existe aucun modèle théorique exact décrivant l'ensemble de leurs propriétés telles que points de fusion et de vaporisation, dureté, propriétés thermiques et électriques etc.
Espaces vides. Grille et géométrie.
Référence à la figure 236. Forme courte ou forme longue.
Pourquoi 14 ou 30 cases vides sur la ligne de la période 1?
Pourquoi 10 ou 24 cases vides sur la ligne de la périodes 2?
Pourquoi 10 ou 24 cases vides sur la ligne de la périodes 3?
Pourquoi 14 (ou 0) cases vides sur la ligne de la périodes 4?
Pourquoi 14 (ou 0) cases vides sur la ligne de la périodes 5?
Dans la forme longue, 118 cases occupées dans une grille de 224 cases, 106 cases vides.
Ces observations n'ont de valeur critique que si on suppose un modèle adopté d'avance en vertu d'une hypothèse ou d'une théorie. Or le modèle qui a fait fortune depuis le début de l'ère mendélévienne est un tableau rectangulaire. Son premier exemplaire semble être celui présenté par Newlands devant la Chemical Society à Londres en 1865. Figure 237.
http://webserver.lemoyne.edu/faculty/giunta/newlands.html
On the Law of Octaves.
Chemical News Vol. 12, Aug. 18, 1865, p. 83.
Cela suggère que la grille rectangulaire n'est pas une forme géométrique particulièrement adaptée à la classification des éléments. On pourrait chercher d'autres formes en se basant sur des principes de symétrie. Les principes de symétrie et de conservation ont joué un rôle important dans les progrès de la physique subatomique.

Fig. 238. Newlands, 8 août 1865. Tableau rectangulaire en cases et en numéros atomiques de Cannizarro. En 1869 et en 1871, Mendeleev employait encore les poids atomiques. Ce tableau montre des répétitions selon le nombre 7.
Des éléments inconnus?
Si au contraire on prétendait que la grille rectangulaire est la forme géométrique adaptée à la classification des éléments, il faudrait postuler que les cases vides correspondent à des éléments inconnus restant à découvrir. Voici leurs nombres, en adoptant la version longue.
.
...................30 éléments nouveaux sur la ligne de la période 1..
................... 24 éléments nouveaux sur la ligne de la période 2..
................... 24 éléments nouveaux sur la ligne de la période 3..
...................14 éléments nouveaux sur la ligne de la période 4..
................... 14 éléments nouveaux sur la ligne de la période 5..
................... 106 éléments nouveaux à découvrir au total. Raisonnant par interpolation, un peu comme dans le cas du gallium etc, il existerait 106 éléments qui trouveraient leur place dans les cases présentement vides du tableau de Mendeleev, ce qui serait très surprenant. Mieux vaut voir là un argument à l'encontre de la géométrie rectangulaire.Le critère électronique. Les scandides, nouvelle famille de terres rares
Selon le critère électronique, au point de vue de la continuité des blocs f, le tableau de Seaborg ne paraît pas satisfaisant, et la même critique s'applique à plusieurs autres versions du tableau de Mendeleev. Figure 230.
Les lanthanides devraient commencer avec La et se terminer avec Yb. Les actinides devraient commencer avec Ac et se terminer avec No. L'examen du tableau de Mendeleev dans cette région a conduit le présent auteur à proposer la création d'une 3e famille de terre rares, celle des scandides : Sc, Y, Lu, Lr. Figure 239.
Le critère électronique. À suivre.
Au point de vue des symétries, le tableau de Janet est séduisant. La période contenant H et He n'est plus à part, elle se trouve pairée. La ligne suivante de 2 cases ne renferme cependant pas de gaz rare.
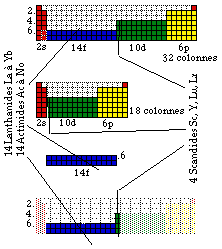
Fig. 239. 3 familles de terres rares, dont celle des Scandides, famille nouvelle proposée par le présent auteur. 32 terres rares au total.
Dans le chapitre suivant, nous allons essayer d'appliquer le critère électronique dans le système du québécium. Le nombre d'électrons et le numéro atomique Z sont des critères de classement indéniables et fondamentaux, étant mieux définis que les multiples propriétés physiques et chimiques qu'ils déterminent pour un élément donné.
N. B. Pour références utiles : http://www.webelements.com/ Réf. Winter, Sheffield; http://www.jergym.hiedu.cz/~canovm/vyhledav/varianty/francie2.html Réf. jergy; http://www.chemistrycoach.com/periodic_tables.htm#Periodic Tables of Historical Interest Réf. chem. coach.
Annexe B.
Références Chancourtois Comptes rendus de l'Académie des sciences de Paris.
1.
CR 7 avril 1862.Mémoire sur un classement naturel des corps simples ou radicaux appelé vis tellurique, 757-761, 54, 13, 1862.
http://gallica.bnf.fr/scripts/ConsultationTout.exe?O=0003011
CR1862, I à VI.
1bis. Charles Sainte-Claire Deville. Lithologie. Essai sur la répartition des corps simples dans les substances naturelles. (14 avril) 1862, (54, 45?), 782-787
2. CR 21 avril 1862, Suite du mémoire de la vis tellurique, du 7 avril 1860 (sic), adressé à propos du thallium, 479-482.
3. CR 5 mai 1862.
Sur un classement des corps simples ou radicaux appelé vis tellurique. - Addition au mémoire présenté à la séance du 7 avril:
... et du 21 avril, 54?, 840-843 (SC Deville...). La communication...
4. CR 16 mars 1863.
Application de la vis tellurique dans la théorie de l'acier, 1863, 56, 253-255 1er semestre. aigre
5. Tableau du classement naturel des corps simples, dit vis tellurique, 600, 45, 1862, 15, 1er semestre. J'ai l'honneur
tellurique http://gallica.bnf.fr/scripts/page.exe?O=0003012&E=00000599
6. Mémoire supplémentaire 16 mars 1863.
Mémoires lus.
Sur un classement des corps simples ou radicaux appelé vis tellurique. - Addition au mémoire présenté à la séance du 7 avril:
... et du 21 avril, 967, 968. J'ajouterai...
7. CR /1863, 56, 1217, 1218, 1er semestre, Correspondance ... présente ... tableau lithographié... Moniteur 28 mai 1863.
http://gallica.bnf.fr/scripts/ConsultationTout.exe?O=0003011CR1862 , I à VI.
![]()
QbSyst2e.18.html
Système du Québécium
Suivant QbSyst2e.19.html
Précédent
QbSyst2e.17.htmlDébut QbSyst2e.1.html